■研究の概要
日本は資源小国といわれますが、海に囲まれる島国日本は、ハロゲン注1)の資源大国であります。例えば、ハロゲン元素のひとつであるヨウ素(I)については、日本は世界第2位の生産・輸出国であり、実に世界需要のおおよそ30%を担っています。更に、日本が生産するヨウ素の75%は千葉県から生産されています。
ハロゲンという重要な天然資源に恵まれた日本において、ハロゲンの新しい機能を基礎研究から見いだし、付加価値の高いハロゲン製品の開発に繋げていくことは、大変重要です。
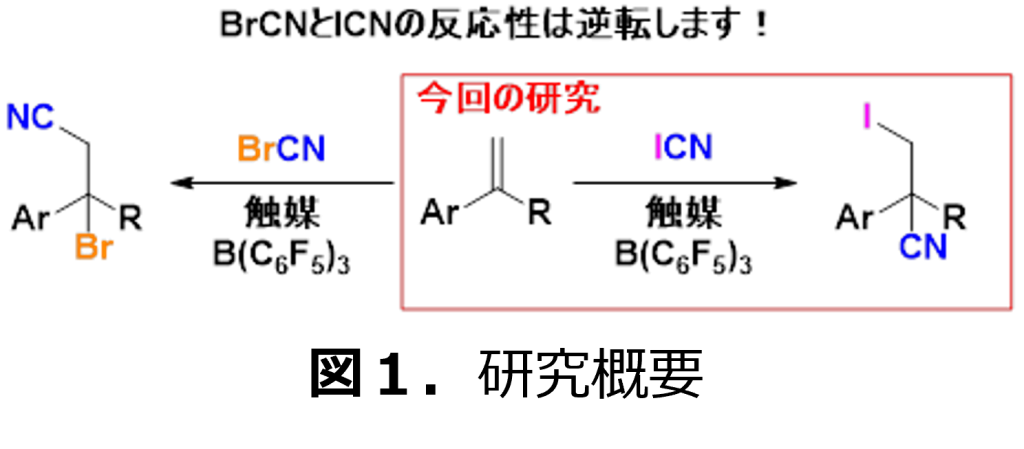
千葉大学大学院理学研究院の荒井孝義教授(千葉ヨウ素資源イノベーションセンター(CIRIC)長)らの研究チームは、ヨウ化シアン(ICN)を用いて、炭素-炭素二重結合を有するアルケン化合物に、ヨウ素とシアノ基(ニトリル)を同時かつ効率的に導入することに成功しました(図1)。他のハロゲン化シアンとは、全く異なる反応の位置選択性(原料の構造中のどこに反応したかの選択性)であり、ヨウ化シアンにだけ見られる特徴的な反応です。このため、従来にない有機分子を合成できるようになり、ヨウ素ならびにニトリルを有する新規機能性分子の創製が期待されます。
本研究成果は、学術誌 Advanced Synthesis & Catalysis にて2023年7月27日に公開されました。
■研究の背景
アルケンのハロシアノ化は合成化学で重要な変換反応の一つで、アミノ酸合成や薬剤の合成など幅広い有機化学の研究や産業で広く利用されています。中でもハロゲン化シアンを用いると、極めて原子効率注2)に優れた反応となります。しかしながら、常温、大気圧下で気体の塩化シアン(毒ガス)や液体の臭化シアンは毒性が強く、大変取り扱いが難しい試薬です。一方、比較的安定な結晶性固体のヨウ化シアンは取り扱いが容易です。
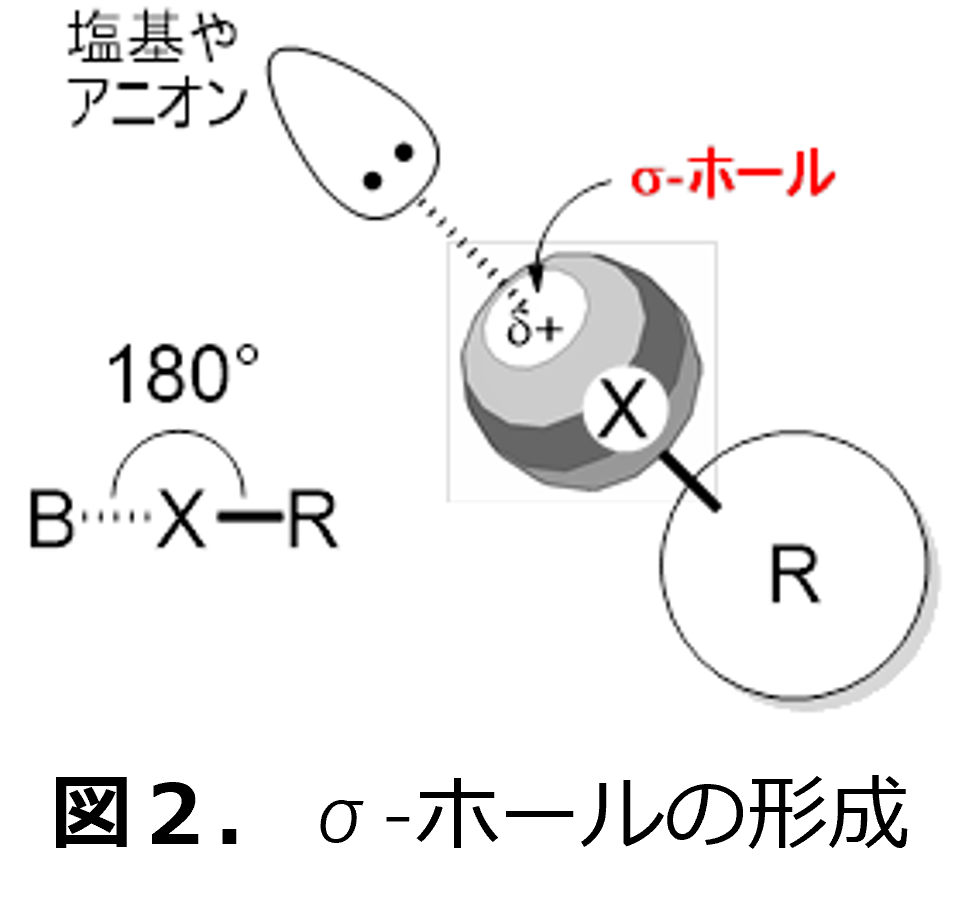
ハロゲンが示す性質として、近年、σ(シグマ)‐ホールの形成によるハロゲン結合が注目されています。σ‐ホールは、図2に示されるように、分子骨格のR-X結合の裏側に発現し(図中、d+で示した部分)他の分子の部位を引き寄せ、分子間の相互作用や相手分子を活性化することに役立ちます。σ‐ホールは、原子半径の大きなハロゲン(具体的には、塩素、臭素、ヨウ素)に多く見いだされていることから、「ハロゲン結合」とも呼ばれ、図2のように明確な方向性をもち、ソフト性注3)の高い化学種(官能基)を選択的に活性化できます。このため、私たちの周りに広く存在する「水素結合」とは異なった性質・選択性を示すと期待されています。
■研究の成果
荒井教授らの研究グループは、ハロゲン化シアンのシアノ基(ニトリル基)は、電子を吸引する性質が強いため、有効なσ‐ホールを形成するものと考えました。このことについて、計算科学を用いて検証すると、図3に示すように各ハロゲンの上に青色で示したσ-ホールが出現し、中でもヨウ化シアンのヨウ素上のσ-ホールが大きいことがわかりました。
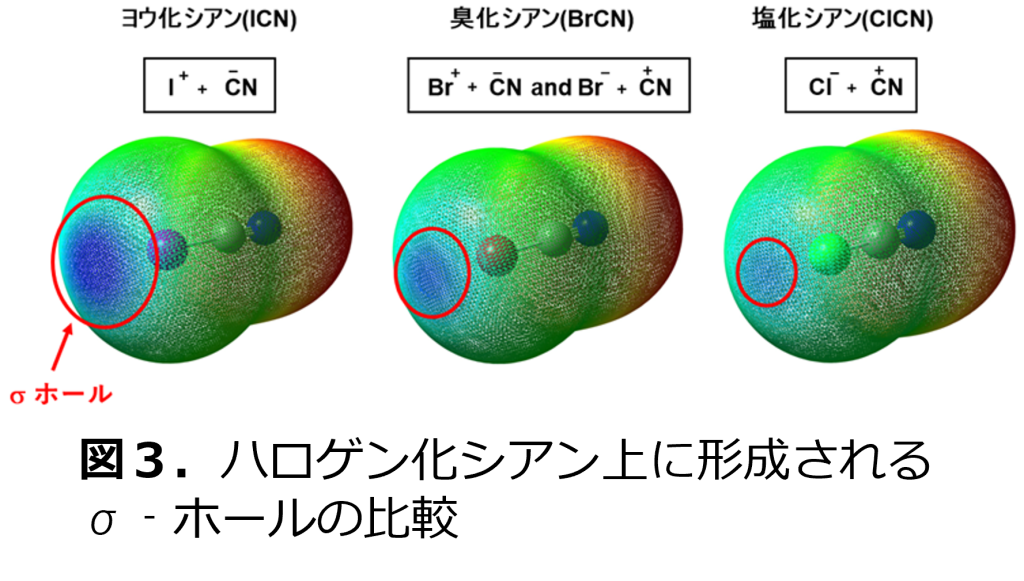
ここで、ハロゲン化シアンの反応性について、過去に報告されている例を振り返ってみます。臭化シアンは、大学で学ぶ生化学の教科書などに「たんぱく質のメチオニン残基特異的に切断する試薬」として登場する試薬です。その反応機構は、メチオニン残基の硫黄原子が臭化シアン中でカチオン性の高いシアノ基の炭素上に求核攻撃することから始まると学びます。即ち、Br-とCN+の反応性を持っているのが臭化シアンです。図3で臭化シアンにもσ-ホールがありますが、Br+として反応するには不十分であるということになります。また、今年になり、大阪大学の南方-清川らの研究グループがアルケンと臭化シアンの反応を報告していますが、ここでもアルケンがCN+と反応しています(参考文献1)。一方、ヨウ化シアンのヨウ素上に大きく出現するσ-ホールは、ヨウ化シアンがI+として反応することを期待させました。
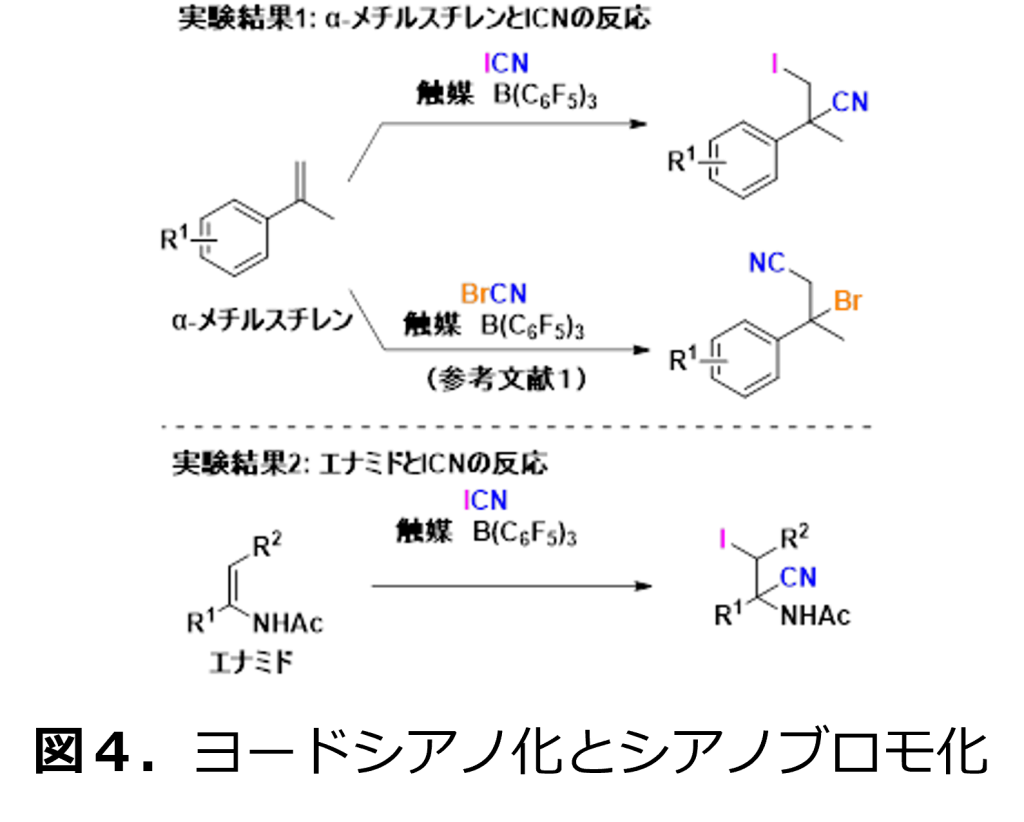
そこで、容易に入手可能なアルケン化合物を基質に使用して、ヨウ化シアンとの反応を試みました。図4の実験結果1に示すようにα-メチルスチレンとヨウ化シアンのみの反応性は十分に高いものではありませんでしたが、トリスペンタフルオロフェニルボラン(B(C6F5)3)を触媒として用いることで、ヨードシアノ化反応が進行することを見出しました。この時、参考文献1に報告された臭化シアンとは全く逆の反応性を示し、アルケンがカチオン性のヨウ素(I+)へ反応が進行することがわかりました(図4)。
臭化シアンとヨウ化シアンで異なる生成物が得られたのは、ヨウ素上の大きなσ‐ホールによるものと理解できます。ソフト性の高いσホールは、本研究のように反応の選択性を制御する重要な要因になりますので、幅広い反応開発に適用できる成果となります。
また、図4の実験結果2に示すように、炭素-炭素二重結合のアルケンにアミド(AcNH)が結合したエナミド基質でもB(C6F5)3を触媒に用いるヨードシアノ化が効率的に進行することを見出しました。
■今後の展望
今回の反応でエナミド基質をヨードシアノ化した生成物からは、下の反応式に見られるように、機能性材料や医農薬などの生物活性物質に見いだされるオキサゾリン化合物を容易に合成できます。ヨードシアノ化の反応条件も極めて温和ですので、天然物や生物活性物質の合成に適用することが期待されます。
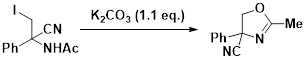
■用語解説
注1)ハロゲン:周期表17族元素の総称で、フッ素、塩素、臭素、ヨウ素、アスタチン、テネシンの6種類がある。(アスタチン、テネシンは放射性元素で私たちの身の回りには存在しない。)天然における存在量は塩素>フッ素>臭素>ヨウ素の順。17族元素として電気陰性度が大きいという共通した性質を示す一方、元素によって固有な反応性も示し、工業から医薬まで幅広い分野で用いられている。
注2)原子効率(アトムエコノミー):原料に試薬などを作用させて生成物を得る反応を行う際、生成物以外に不要な物質が生じることがある。ムダにならずに使われる原子の割合を反応式(1)で示し、化学変換プロセスの効率を表す指標。

■研究プロジェクトについて
本研究は、以下の研究課題の支援を受けて行われました。
- 科学研究費補助金 基盤研究(B) 19H02709
「ハロゲン結合の動的構造制御に基づく高活性精密反応場の構築」
- 千葉大学国際高等研究基幹学際的先端研究支援プログラム
「千葉ハロゲン科学:ハロゲンで繋ぐ分子機能」
■論文情報
タイトル:Halogenation/cyanation vs. Cyanation/halogenation of Alkenes Using ICN and BrCN
著者:Ikumi Furusawa, Takumi Suzuki, Yan Yu, Takayoshi Arai*
雑誌名:Advanced Synthesis & Catalysis
DOI:https://doi.org/10.1002/adsc.202300458
■参考文献
BrCNを用いるシアノブロモ化反応の論文:
タイトル:Tris(pentafluorophenyl)borane-Catalyzed Stereospecific Bromocyanation of Styrene Derivatives with Cyanogen Bromide
著者:K. Kiyokawa, I. Noguchi, T. Nagata, S. Minakata.
雑誌名:Org. Lett.
DOI:https://pubs.acs.org/doi/10.1021/acs.orglett.3c00727
■補足説明

【千葉ヨウ素資源イノベーションセンター(センター長:荒井 孝義)】
千葉が生産するヨウ素の高機能化を目指し、平成28年度文部科学省 地域科学技術実証拠点整備事業に採択されました。600MHz NMRやXPSなど最先端分析機器を整備し、産学官共同研究を推進する拠点として、平成30年春に西千葉キャンパスに竣工しました。








