千葉大学大学院理学研究院(膜タンパク質研究センター、分子キラリティー研究センター兼任)の村田武士教授、大学院医学研究院の斎藤哲一郎教授、大学院医学薬学府博士後期課程2年の宮下靖臣らは、オックスフォード大学、高エネルギー加速器研究機構(KEK)物質構造科学研究所との共同研究により、薬剤の副作用によって引き起こされる薬剤誘発性心突然死の原因タンパク質であるhERGチャネル(注1)と副作用誘発薬剤の結合モデルを、クライオ電子顕微鏡(Cryo-EM)(注2)を用いて明らかにすることに成功しました。
本研究成果は、hERGチャネルと薬剤の結合情報に基づいて薬剤の設計や改変を可能にし、より安全な新薬を迅速に市場に送り出すための重要な手がかりとなることが期待されます。
本論文は、2024年9月24日に米国科学誌Structureにオンラインで掲載されました。
■研究の背景と経緯
薬剤による副作用は製薬業界における重大な問題であり、特にhERGチャネルの遮断による薬剤誘発性心不整脈は、新薬開発において大きな障害となっています。hERGチャネルは心臓の活動電位の再分極を制御する重要な役割を果たします。そのため、hERGチャネルの阻害は致命的な不整脈を誘発します。実際に、抗アレルギー薬として開発されたアステミゾールは、服用した患者が突然死したことにより市場から撤退しました。そのため、hERGチャネルと薬剤の結合情報に基づいて薬剤の設計や改変を行うことは、hERGチャネルへの薬剤の結合を回避するための有効な手段と考えられます。これを行うためには、hERGチャネルと薬剤の結合構造の把握が必要不可欠です。
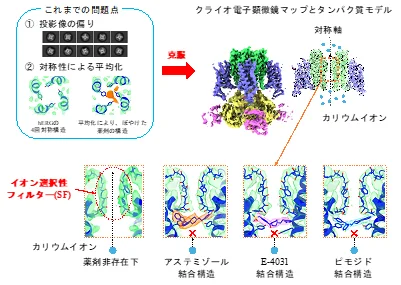
2017年に、薬剤が結合していないhERGチャネルの構造が報告され、hERGチャネルは4回対称の4量体の構造を持っていることが明らかとなりました。(参考資料1)。我々の研究室では2021年に、アステミゾールが結合していると考えられる構造を報告しました(参考資料2)。しかし、我々の構造には、以下の二つの問題がありました (図1左上)。
①投影像が特定の方向に偏る「プリファードオリエンテーション(注3)」により、達成可能な分解能が大幅に制約されてしまう。
②単粒子解析(注4)の際、対称軸上に結合した薬剤が4回対称を持つhERGチャネルに対して極端に小さいために、異なる結合の向きが予想されるにも関わらずこの対称性に引っ張られて、薬剤の構造が平均化されてぼやけてしまう。
これらの問題により、hERGと薬剤の詳細な結合構造を得ることは難しく、hERGと薬剤の詳細な結合メカニズムを明らかにした研究はこれまでにありませんでした。そこで本研究では、これらの問題を解決し、hERGと薬剤の詳細な結合構造を明らかにすることを目指しました。
■研究成果
本研究では、薬剤が結合したhERGチャネルの構造解析のための新しい手法を開発し、3種類の薬剤 (アステミゾール、E-4031、ピモジド) のそれぞれについて詳細な結合構造を明らかにすることに成功しました。
hERGチャネルの構造解析には、他のタンパク質からhERGチャネルを分離・精製し、界面活性剤でその構造を保護することが重要です。本研究では、まず数種類の界面活性剤を検討し、Cryo-EMを用いて観察を行った結果、プリファードオリエンテーションの問題を改善する界面活性剤を見つけ、hERG分子の投影像を多様な方向から得ることに成功しました。さらに、②の対称性による平均化の問題に対しては、従来の解析法を工夫し、薬剤が結合していない粒子を除去し、薬剤の結合位置に限定した詳細な位置合わせを行うことで、鮮明な薬剤の構造を得ることに成功しました。
3つの薬剤はいずれも、hERGのイオン選択性フィルター(SF) (注5)の下に結合しており、カリウムイオンの通り道を塞いでいることが明らかになりました (図1)。
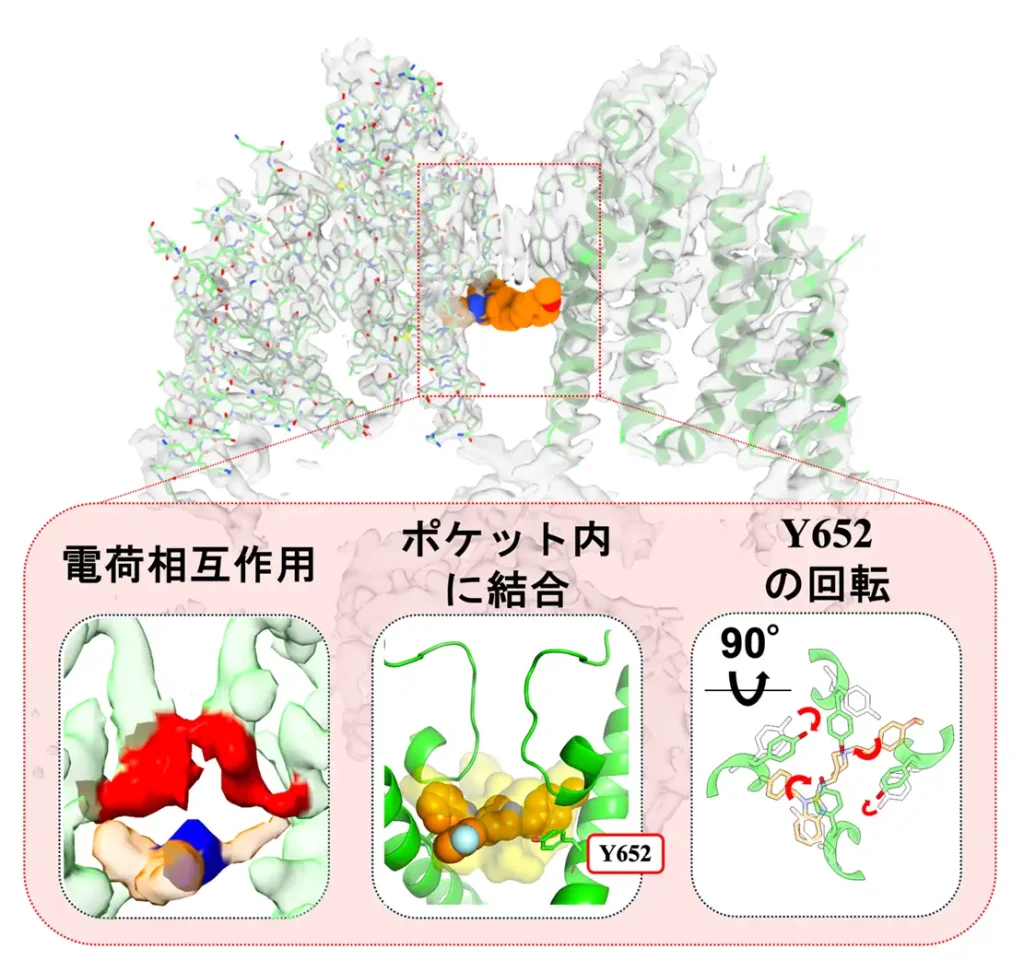
また、これらの結合構造を比較することで、hERGと薬剤は、薬剤の正電荷領域(図2左、青)とhERGのSFの負電荷領域(図2左、赤)の電荷相互作用により結合していること、SFの下にあるポケット内に収まって結合 (図2中央)していること、652番目に位置するチロシン(Y652)の側鎖の回転 (図2右)によって結合していること、の3つの共通点があることが明らかとなりました。
■今後の展開
本研究で得られたhERGチャネルと薬剤の結合様式の理解は、薬剤設計において重要な手がかりとなります。この知見を活用することで、薬剤がhERGチャネルに与える副作用を予測し、そのリスクを回避するための薬剤設計が可能になります。これにより、新薬の開発プロセスが効率化され、市場投入までの時間が短縮されるとともに、より安全、安心な薬剤の提供につながることが期待されます。
■研究プロジェクトについて
本研究は、創薬等先端技術支援基盤プラットフォーム (BINDS) や、日本学術振興会 (JSPS) 等の支援を受けて行われました。
■用語解説
注1)hERG (human ether-à-go-go related gene) チャネル:主に心臓の細胞膜に存在する電位依存性カリウムチャネルの一種。心臓のリズムを整えるために重要な役割を果たしており、機能異常により、心臓のリズムが乱れ、重篤な不整脈を引き起こす可能性がある。また、一部の薬剤がこのチャネルを誤って遮断することで、副作用として致命的な心臓のリズム異常を引き起こすことがある。
注2)クライオ電子顕微鏡 (Cryo-EM): 極低温で急速に凍らせたタンパク質試料を極低温状態に保ったまま電子線写真を撮影することのできる透過型顕微鏡。
注3)プリファードオリエンテーション:タンパク質の性質などにより得られた投影像の投影方向が偏る現象。Cryo-EM単粒子解析において分解能を制限する大きな要因となる。
注4)単粒子解析: Cryo-EMで取得した様々な投影方向を持つ粒子の2次元の投影像を使って、粒子の3次元構造を再構成する手法。まず、様々な2次元の投影画像の位置や向きを調整し、粒子の投影方向を推測する。次にこれらの情報を用いて逆投影を行い、3次元構造を組み立てる。この方法により、タンパク質分子の構造を観察できる。
注5)イオン選択性フィルター: イオンチャネル内に存在し、特定のイオンが通過できるかどうかを決定する領域。イオンチャネルが通過できるイオンの種類や選択性を決める。
■論文情報
論文タイトル:Revealing the Binding Modes of hERG Channel Inhibitors with Improved Cryo-EM Resolution
著者情報:Yasuomi Miyashita, Toshio Moriya, Takafumi Kato, Masato Kawasaki, Satoshi Yasuda, Naruhiko Adachi, Kano Suzuki, Satoshi Ogasawara, Tetsuichiro Saito, Toshiya Senda, Takeshi Murata* (*責任著者)
掲載誌:Structure
DOI:doi.10.1016/j.str.2024.08.021
■参考資料
(1) Wang W, and MacKinnon R. Cell, 2017.
(2) Asai T, et al, Structure, 2021.









