発表のポイント
- 放射性医薬品は次世代のがん画像診断・がん治療薬剤として大きな注目を集めています。これまでは、薬をがん病巣に到達させる技術の開発に力が注がれてきましたが、肝臓など健常な組織にも薬が分布してしまうのを避けることができませんでした。
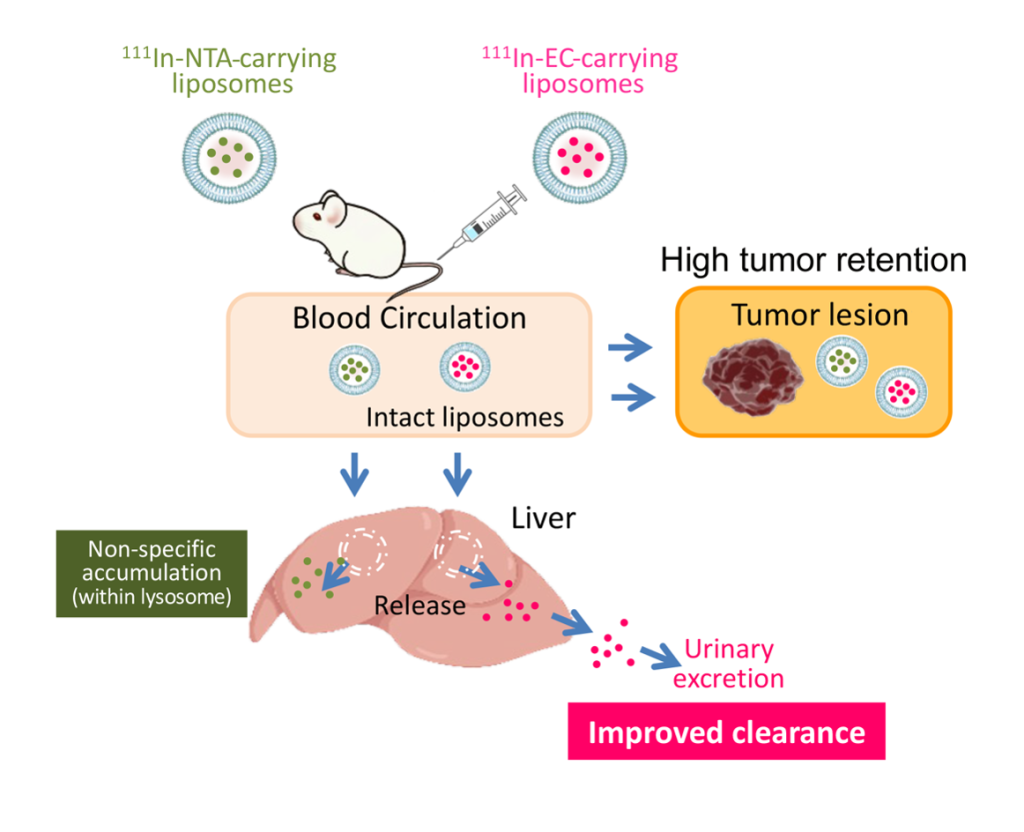
- 放射性医薬品を用いる核医学に薬物送達システム(Drug Delivery System, DDS)、さらに錯体化学を組み合わせることで、健常組織への薬の分布を抑えるのではなく、いったん分布した薬を迅速に体外に排出させる新たな手法を開発しました。
- 本手法によって、がん病巣に放射性医薬品を充分に集積させると同時に、健常組織への薬の停滞時間を大きく短縮させ、結果として、がん病巣だけに薬を集中させ、がん病巣への薬の作用を従来よりも飛躍的に改善させることに成功しました。
- 本研究成果により、難治性がん画像診断の精度向上、健常組織への毒性低減、治療効果向上などが期待できます。
概要
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)先端医療開発センター(センター長 土井俊彦) 機能診断開発分野の梅田泉研究員、藤井博史研究員などからなる研究チームは、千葉大学大学院薬学研究院、東京大学国際高等研究所カブリ数物連携宇宙研究機構、京都医療科学大学との共同研究で、核医学に薬物送達システム(Drug Delivery System, DDS)と錯体化学という異分野領域を巧みに組み合わせることで、健常組織への薬の分布を抑えるのではなく、いったん分布した薬を迅速に体外に排出させる新たな手法を開発しました。
放射性医薬品を用いた核医学がん画像診断・がん治療は、診断と治療の一体化を可能とする次世代の高精度がん診療(セラノスティクス)として多くの注目を集めています。放射性医薬品をがん病巣に集めることで、がんを正しく診断し、かつ効果的に治療を行うことが可能です。しかしながらこれまでは、がん以外の健常組織、特に肝臓などにも集積してしまうという問題点が未解決でした。この問題に対して、研究チームでは発想を転換し、集積を抑制するのではなく、いったん肝臓などに集積した後に、これを速やかに排泄させて、結果的に肝臓や脾臓への放射性同位元素(RI)停滞を大幅に低減し、がんの診断や選択的治療の妨げにならない手法の開発を手がけました。具体的には、リポソームに、111In-エチレンジシステイン(111In-EC)という独自の錯体で標識したRIを封入した新規製剤を開発しました。
今回開発した新しい手法によって、がん病巣への高い集積を保ったまま、肝臓などの健常組織では一旦取り込まれるものの、速やかに消失して尿として体外に排泄され、結果としてがん病巣のみにRIを集中させることができました。この画期的なアプローチによって、難治性がん画像診断の精度向上、健常組織への毒性低減、治療効果向上などが期待できます。
本研究の成果は医学雑誌「Journal of Controlled Release」に2023年8月23日付(オンライン版)で掲載されました。
プレスリリース本文はこちら








