千葉大学大学院医学研究院イノベーション再生医学の髙山直也准教授、Sudip Kumar Paul特任研究員、江藤浩之教授(兼 京都大学iPS細胞研究所 教授)らの研究グループは、同大学の内分泌代謝・血液・老年内科学 横手幸太郎教授(現千葉大学長)らの研究グループと共同で、ヒトiPS細胞から誘導したマクロファージ注1)、血管内皮細胞注2)、血管平滑筋細胞注3)を用いて、試験管内で動脈硬化注4)を模倣するモデルを確立しました。
動脈硬化を早期に発症する早老症の一つであるウェルナー症候群(WS)注5)患者由来細胞と健常者由来細胞を比較したところ、WS患者由来マクロファージにおいて、炎症性マクロファージの特徴が強まることが動脈硬化の原因となる血管炎症を誘導することが明らかになりました。
本研究で、遺伝的背景を揃えたマクロファージや血管構成細胞との直接的な影響を観察する新たな研究プラットフォームを提供することにより、今後は動脈硬化に対する病態解明や創薬開発への応用が期待されます。
この研究成果は、2024年6月10日(英国夏時間)に国際学術誌Nature Communicationsにオンライン掲載されます。
■研究の背景
動脈硬化は、心筋梗塞や脳梗塞などの致命的な虚血性疾患の主要な原因で、血管内皮細胞、血管平滑筋細胞、間葉系幹細胞およびマクロファージなどの免疫細胞が相互作用して発症することが明らかになっています。先行研究では、主に生体内での細胞間相互作用を観察する優れた解析系であるApoE-/-マウスなどのモデル動物を用いた病態研究が中心に進められてきました(参考文献1-3)。他方、詳細な病態解析のためには、試験管内での培養細胞を用いた解析系の確立も重要であり、モデル動物での解析だけでは創薬のための大規模な薬剤スクリーニングが困難です。
動脈硬化の発症メカニズム研究では、遺伝的背景を揃えた複数細胞の初代培養、さらに共培養の実現化が達成できずにいたため、動脈硬化研究の基本プラットフォームが更新されていない状況が続いています。
WS患者さんは、早期の動脈硬化関連死が多いことが報告されているにもかかわらず、原因遺伝子であるWRN遺伝子ノックアウトマウスでは患者さんと同様の顕著な動脈硬化を示さず、WSにおける分子レベルでの動脈硬化発症メカニズムは不明です。そのため、WRN遺伝子変異を持つ細胞での解析系の確立が希求されていました。
■研究の成果
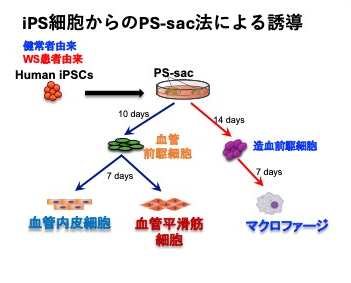
本研究ではまず、研究グループの技術(参考文献4, 5)を基盤に、マクロファージ、血管内皮細胞、血管平滑筋細胞を正常、あるいはWS患者由来iPS細胞から分化させる系を確立しました(図2)。興味深いことに、WS由来血管内皮細胞、血管平滑筋細胞はそれぞれ単独では、明らかな異常は見られませんでした。一方で、WS由来マクロファージでは、細胞増殖能の低下や老化マーカーの上昇、炎症性サイトカイン産生の亢進などの炎症性変化が顕著でした。
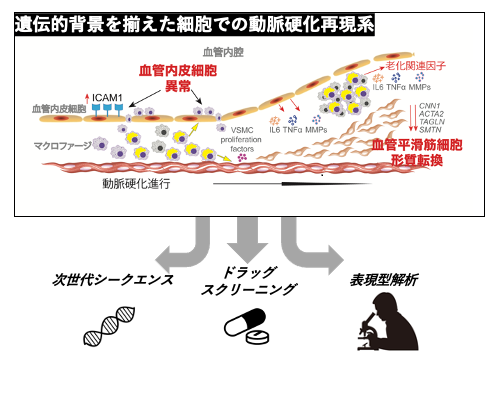
次に、これらの細胞を共培養することで、動脈硬化の早期の変化である血管細胞の炎症性変化の再現を試みました。マクロファージと血管内皮細胞を共培養すると、細胞接着因子の上昇や、炎症性サイトカインの遺伝子発現上昇などの動脈硬化の際に観察される血管内皮細胞の炎症性変化が、WS由来細胞で顕著に観察されました。同様に、マクロファージと血管平滑筋細胞を共培養すると、成熟した血管平滑筋細胞のマーカータンパクや遺伝子発現が低下していました。以上から、特にマクロファージが、WSにおける動脈硬化促進の主要な原因細胞であることが明らかになりました。
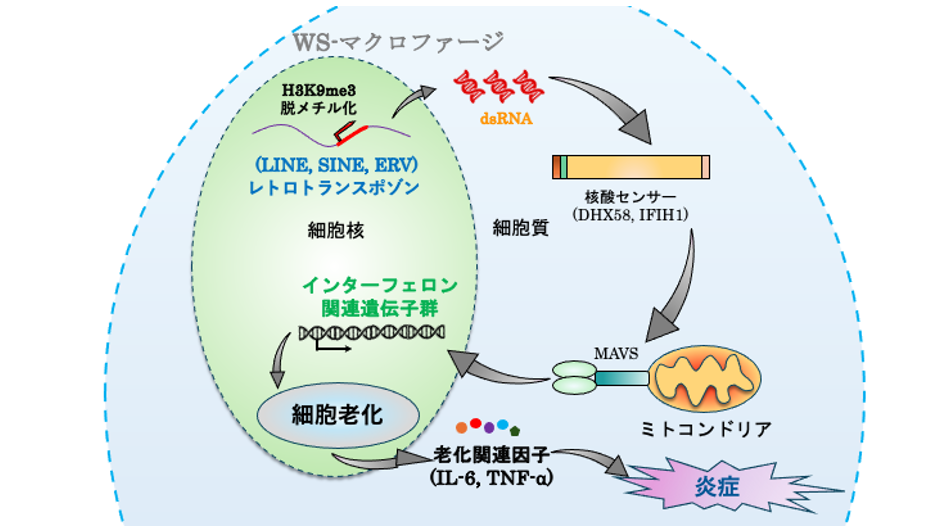
さらに、WS由来マクロファージの異常な炎症活性化の原因を明らかにするために、網羅的な遺伝子発現解析やエピゲノム解析を実施しました。その結果、WS iPS細胞由来、WS患者末梢血由来のWSマクロファージにおいては、共通してレトロトランスポゾン注6)領域のエピゲノム変化に伴う異常な再活性化が観察されました。これにより、細胞内に二重鎖核酸が蓄積し感知された結果、インターフェロンシグナル注7)の異常活性化が誘導されていることが強く示唆されました。これら一連の反応の結果、WSマクロファージでは、炎症性の特徴がより強く現れることが病態であると結論づけられました。
■今後の展望
本研究では、WS患者さんにおける動脈硬化の早期発症における分子メカニズムを明らかにしました。この結果、レトロトランスポゾンなどの細胞内核酸やインターフェロンシグナル経路を標的にする薬剤が、病態の進行を遅らせる可能性が強く示唆されます。さらに、本研究で開発された動脈硬化再現細胞モデルは、動脈硬化治療に有効な創薬検索のための有益なプラットフォームになると考えられます。これにより、新規の抗動脈硬化薬の開発に向けての貢献が期待されます。
■参考文献
1. Plump AS, et al. Severe hypercholesterolemia and atherosclerosis in apolipoprotein E-deficient mice created by homologous recombination in ES cells. Cell 1992;71(2):343-353.
2. Ishibashi S, et al. Hypercholesterolemia in low density lipoprotein receptor knockout mice and its reversal by adenovirus-mediated gene delivery. J Clin Invest. 1993;92(2):883-893.
3. Getz GS, Reardon CA. Animal models of atherosclerosis. Arterioscler Thromb Vasc Biol. 2012;32(5):1104-1115.
4. Takayama N, et al. Generation of functional platelets from human embryonic stem cells in vitro via ES-sacs, VEGF-promoted structures that concentrate hematopoietic progenitors. Blood 2008;111(11):5298-5306
5. Takayama N, et al. Transient activation of c-MYC expression is critical for efficient platelet generation from human induced pluripotent stem cells. J Exp. Med. 2010; 207(13):2817-30
■ 用語解説
注1)マクロファージ:体内の異物や細胞の老廃物を処理する免疫細胞の一種。血液や組織に存在し、炎症や感染に応じて活性化される。酸化脂質を取り込むことで活性化し、炎症性サイトカイン分泌などを介して動脈硬化への発症に関与している。
注2)血管内皮細胞:血管内腔を覆う細胞であり、血管壁と血液の間の隔壁を形成している。血管の健康状態を維持するとともに、動脈硬化発症時においても重要な役割を果たす。
注3) 血管平滑筋細胞:血管壁に存在する筋肉細胞の一種。外部からの刺激に応じて収縮・緩和することで、血管の内径や血液流量を制御する。これによって、体内の各組織や臓器に適切な量の酸素や栄養素が供給される。動脈硬化が進行する際に、炎症性サイトカインなどの影響で、成熟した平滑筋が脱分化し、増殖を開始する(形質転換)。これが動脈硬化プラーク形成に重要な役割を果たす。
注4) 動脈硬化:血管壁にコレステロールやその他の脂質が蓄積し、炎症反応や石灰化が進行する疾患。進行すると、心筋梗塞や脳梗塞などの致死的な疾患につながる。
注5)ウェルナー症候群(WS):常染色体劣性遺伝疾患の一つであり、主に早期老化や様々な老化関連疾患が特徴的である。WRN遺伝子の変異によって引き起こされ細胞の老化が加速される。思春期を過ぎた頃から加速した老化現象を示し、通常は40代から50代には老化関連疾患に罹患する。
注6)レトロトランスポゾン:ゲノム内の遺伝子配列を複製して挿入する能力を持つDNA配列の一種。これらのDNA配列は、逆転写酵素と呼ばれる酵素によってRNAを逆転写してDNAに変換し、ゲノム内に再挿入される。真核生物のゲノム内に広く分布しており、ゲノムの進化や多様性に影響を与える重要な要素であり、その一部は、疾患の原因となる突然変異を引き起こす可能性が報告されている。
注7)インターフェロンシグナル:免疫応答における重要なシグナル伝達経路の一つ。この経路の活性化により、細胞は免疫応答を調節し、ウイルスや細菌の増殖を抑制するための防御反応を開始する。近年、インターフェロンタンパクによる刺激だけでなく、様々なストレス因子もこの経路を活性化することが知られている。
■ 論文情報
タイトル:Retrotransposons in Werner syndrome-derived macrophages trigger type I interferon-dependent inflammation in an atherosclerosis model.
著者:Sudip Kumar Paul, Motohiko Oshima, Ashwini Patil, Masamitsu Sone, Hisaya Kato, Yoshiro Maezawa, Hiyori Kaneko, Masaki Fukuyo, Bahityar Rahmutulla, Yasuo Ouchi, Kyoko Tsujimura, Mahito Nakanishi, Atsushi Kaneda, Atsushi Iwama, Koutaro Yokote*, Koji Eto, Naoya Takayama*
雑誌名:Nature Communications
DOI: https://doi.org/10.1038/s41467-024-48663-w
■ 研究プロジェクトについて
本研究は、下記事業からの支援を受けて実施されました。
・AMED疾患特異的iPS細胞の利活用促進・難病研究加速プログラム「早老症疾患特異的iPS細胞を用いた老化促進メカニズムの解明を目指す研究」
・日本学術振興会 基盤研究(A)、萌芽研究
・公益財団法人東京生化学研究会アジア地域招聘国際共同研究助成金
・文部科学省 外国人留学生奨学金









