■研究の概要:
千葉大学医学部附属病院の岩田有史講師/診療准教授、大学院医学研究院の古矢裕樹医員(研究当時)、戸田陽介特任助教、幡野雅彦教授(研究当時)、中島裕史教授らの研究チームは、アレルギー疾患の発症・難治化に重要な働きをする2型自然リンパ球(ILC2)(注1)の誘導機構を明らかにしました。
研究チームは、ILC2分化に必須の転写因子GATA3(注2)のエンハンサー(注3)機能を解析し、2つのスーパーエンハンサー(SE)(注4)領域がILC2選択的に機能することを発見しました。また、これらの2つのスーパーエンハンサー領域を欠損するマウスを作成したところ、このマウスではILC2の分化がこれまで同定されていなかった成熟ILC2の一段階手前の段階で停止し、成熟ILC2が消失することを明らかにしました。
本研究の成果は、ILC2を制御する新たな治療法の開発に繋がる可能性があり、難治性アレルギー疾患の再燃防止や根治療法の実現に向けた期待が高まります。
本研究成果は、2024年7月5日に、学術誌Nature Communicationsで公開されました。
■研究の背景:
アレルギー疾患は日本人の約4割が罹患する国民病です。多くの研究が行われていますが、依然として原因物質の回避と対症療法が中心であり、完治することは稀です。
近年の研究により、アレルギー疾患の発症・難治化に2型サイトカイン(IL-4、IL-5、IL-9、IL-13)とそれを産生するTh2細胞およびILC2が重要な働きをもつことが明らかとなっています(図1)。抗原刺激とIL-4/STAT6経路の活性化により分化するTh2細胞と、刺激を必要とせずSTAT6が関与しない経路で分化するILC2は、発生の経路は異なりますが、どちらも転写因子GATA3を介して分化し、遺伝子発現の特徴やクロマチン活性化状態(注5)などがよく似ています。IL-4受容体の阻害薬によりTh2細胞の抑制が可能となりましたが、IL-4受容体の阻害薬では抑制が困難なILC2を標的とした治療法は存在しません。そこで、研究グループはILC2特有の分化誘導機構の解明を目指しました。
■研究の成果:
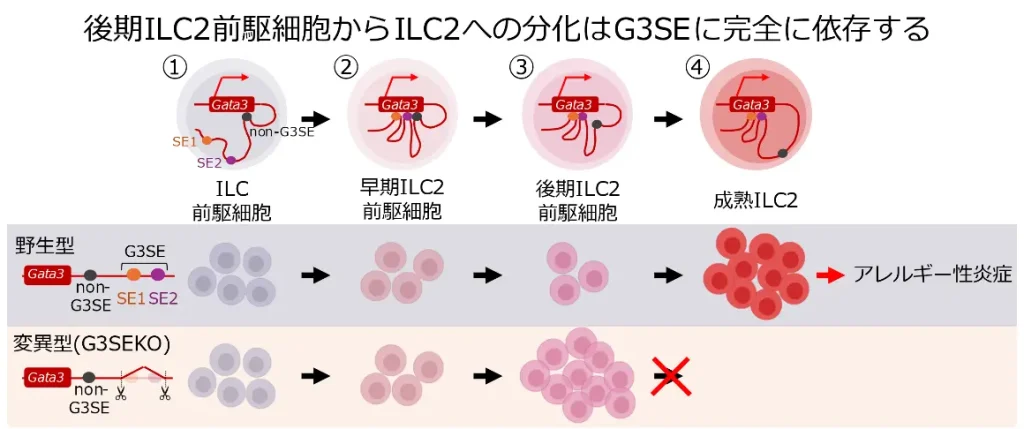
研究チームは、マウスに人工的に気管支喘息を引き起こし、Th2細胞とILC2のクロマチン活性化状態を比較しました。全ゲノム中624個のスーパーエンハンサー領域が同定され、その多くはTh2細胞とILC2で同様に活性化していましたが、ILC2で顕著に活性化する36個のスーパーエンハンサー領域を特定しました。そのうち2つ(SE1:GATA3より678-764kbp下流, SE2:GATA3より500-591kbp下流)は連続してGATA3の近傍に位置しており(併せてG3SEと命名)、ILC2特有のGATA3制御機構に関与していると考えられました。
SE1とSE2を欠損したマウス(G3SEKOマウス)を作製したところ、予想通りG3SEKOマウスではTh2細胞の分化はほとんど正常ですが、ILC2がほぼ完全に欠損していました。ILC2は骨髄で分化し、①ILC前駆細胞、ILC2前駆細胞(我々は②早期ILC2前駆細胞と呼びます)を経て骨髄ILC2へと分化します。G3SEKOマウスではILC前駆細胞、早期ILC2前駆細胞は正常に保たれているものの、新たに我々が見出した③後期ILC2前駆細胞で分化が停止していました。さらに各分化段階のオープンクロマチン解析(注6)により、ILC前駆細胞まではG3SEを介さないGATA3誘導機構が中心的な役割を果たし、早期ILC2前駆細胞ではG3SEを介した誘導機構とG3SEを介さない誘導機構が併存し、後期ILC2前駆細胞ではG3SEを介さないGATA3誘導機構は消失し、完全にG3SEを介する誘導機構に依存することが明らかとなりました。
■今後の展望
本研究により、ILC2分化における後期ILC2前駆細胞の段階でG3SEによるGATA3発現誘導が必須であることがわかりました。今後はG3SEの活性化誘導機構の解明を進めることで、ILC2を標的とする新規治療法の開発が期待されます。
■用語解説
注1)2型自然リンパ球:リンパ球の1種。サイトカイン、神経ペプチド、脂質などの刺激により大量の2型サイトカインを放出し、寄生虫感染、アレルギー疾患、恒常性の維持などに重要な役割を果たします。
注2)GATA3:GATA結合たんぱく質3と呼ばれる転写因子で、DNAに結合して遺伝子の発現を調節する核内タンパク質。リンパ球の分化に中心的な働きを果たしますが、アレルギー疾患だけでなく、乳腺や脳神経系の発生、癌の発生に重要な働きを持ちます。
注3)エンハンサー:標的遺伝子から離れた位置にあり、活性化により遺伝子近傍に位置するプロモーターと協調して遺伝子発現を増幅する領域。同じ遺伝子でも、細胞種や活性化様式によってエンハンサーとして機能する部位は異なります。
注4)スーパーエンハンサー(SE):エンハンサーが集簇する領域のこと。分化や生存、機能などその細胞種の特性に重要な働きを持ちます。
注5)クロマチン活性化:クロマチンはDNAとタンパク質からなる複合体で、その構造が変化することで遺伝子の発現が調節されます。クロマチン活性化は、遺伝子の発現が促進されるようにクロマチンの構造が開放的になる状態を指します。
注6)オープンクロマチン解析:クロマチンが活性化して開放状態にある領域を特定する技術。クロマチンの開放は細胞種や分化段階、活性化状態により動的に変化するため、オープンクロマチン解析により遺伝子発現の調節メカニズムを調べることができます。
■研究プロジェクトについて
本研究は、以下の事業の支援を受けて実施されました。
•日本学術振興会 科学研究費助成事業 基盤研究(C) 2023年度~2025年度(23K07620)
「ILC2特異的スーパーエンハンサーの理解に基づく新規アレルギー疾患制御法の開発」
•AMED 免疫アレルギー疾患実用化研究事業 2019年度~2021年度 (JP19ek0410043h0003)
「スーパーエンハンサー関連遺伝子群の時間・空間的動態解析によるアレルギー性気道炎症誘導における細胞間相互作用の解明」
•AMED SCARDAワクチン開発のための世界トップレベル研究開発拠点の形成事業(ワクチン開発のための世界トップレベル研究開発拠点群 千葉シナジーキャンパス(千葉大学 未来粘膜ワクチン研究開発シナジー拠点), JP223fa627003)
•JSTムーンショット型研究開発事業 2020年度~2025年度 (JPMJMS2025)
「ウイルス-人体相互作用ネットワークの理解と制御」
•GSK Japan Research Grant 2020
「ILC2特異的分化制御に基づくアレルギー性気道炎症克服への基盤構築」
■論文情報
タイトル:Stage-specific GATA3 induction promotes ILC2 development after lineage commitment
著者:Hiroki Furuya†, Yosuke Toda†, Arifumi Iwata†, Mizuki Kanai, Kodai Kato, Takashi Kumagai, Takahiro Kageyama, Shigeru Tanaka, Lisa Fujimura, Akemi Sakamoto, Masahiko Hatano,
Akira Suto, Kotaro Suzuki, and Hiroshi Nakajima (†equally contributed)
雑誌名:Nature Communications
DOI:https://doi.org/10.1038/s41467-024-49881-y









