千葉大学大学院薬学研究院の伊藤素行教授と鈴木翔大日本学術振興会特別研究員PD(受入機関:千葉大学)、静岡県立大学大学院薬学研究院の竹内英之教授、名古屋大学糖鎖生命コア研究所の塚本庸平日本学術振興会特別研究員PD(受入機関:名古屋大学)と岡島徹也教授らの研究チームは、遺伝性脳小血管病CADASIL(注1)の原因として知られるNOTCH3(注2)変異型タンパク質の蓄積に、糖鎖修飾酵素Radical fringe(RFNG)(注3)が寄与することを世界に先駆けて発見しました。この結果によって、糖鎖修飾(注4)を介した新たな病態機構の解明が進み、CADASILの有効な治療法の確立につながることが期待されます。
本研究成果は2024年9月18日に国際学術誌The Journal of Biological Chemistryで公開されました。
■研究の背景:
認知症の病態進行には老化などの環境要因に加え、遺伝的な要因も影響します。国内で、遺伝性の脳卒中によって引き起こされる認知症の半分以上は、CADASILです。患者数が人口10万人あたり数名の希少難病として知られていましたが、最近の研究では、アジア圏でおよそ100人に1人がCADASILもしくはその予備軍と推定されています。CADASILは無症状期間を経た後、老化が遺伝要因と組み合わさることで発症します。しかし、病態の仕組みはまだ完全には解明されておらず、根本的な治療法も存在しません。
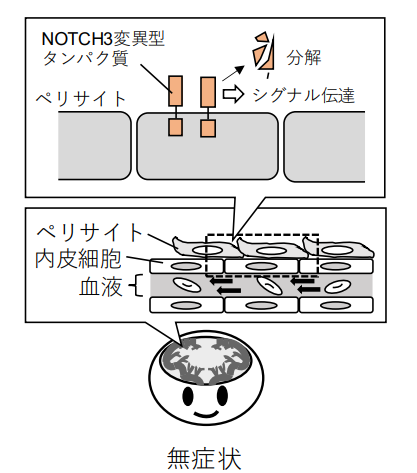
CADASILで障害されるのは、脳の小さな血管です。小さな血管は「ペリサイト(注5)」と呼ばれる細胞によって血流が調節されています(図1)。ペリサイトの生存を促す主なタンパク質は、NOTCH3タンパク質ですが、このタンパク質を作る遺伝子に変異が生じて、「NOTCH3 CADASIL変異型タンパク質」が作られることがあります。これはペリサイトが生存し続け、血流が適切に調節されるためのシグナルである「Notchシグナル(注6)」を弱めるだけでなく、血管の周囲に異常に蓄積することで毒性が発揮され、老化と結びつくことでCADASILを発症すると考えられています。しかし、NOTCH3 CADASIL変異型タンパク質が老化と結びつくことで、どのようにして機能が低下し、タンパク質の蓄積が増加するのか、その詳しい機構は不明でした。
NOTCH3タンパク質は遺伝子に含まれる情報だけでなく、化学修飾の1つである糖鎖修飾を通じて、そのシグナル活性やタンパク質の量が制御されています。研究チームは、老化によってNOTCH3 CADASIL変異型タンパク質の糖鎖修飾が増えることで、Notchシグナルの低下とNOTCH3タンパク質の蓄積が起こると予想しました。そこで、CADASILで見られるNOTCH3遺伝子上に起こる変異の1つであるC185R、R141C変異(注7)に着目して、糖鎖修飾の影響を検証しました。
■研究の成果:
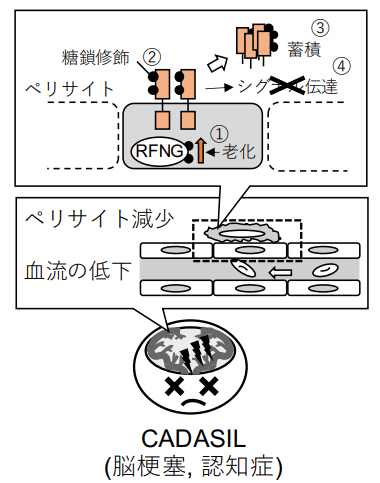
実験の結果、以下のようなメカニズムが明らかになりました(図2)。
①ペリサイトの老化によってRFNGの発現が上昇する
②RFNGは糖鎖修飾を促進する
③NOTCH3 R141CとC185R変異型は正常なものに比べて、RFNGによって蓄積しやすい
④シグナル活性がRFNGによって著しく減弱する
これらの結果から、RFNGが老化によって増えることで糖鎖修飾が促進し、NOTCH3 CADASIL変異型タンパク質であるC185RとR141C変異型がシグナル活性を弱め、さらに蓄積することで、その結果として血流が低下して脳梗塞や認知症を引き起こすという、糖鎖修飾を介した新たなCADASIL病態の機構が考えられました。
■今後の展望
CADASILの原因となるNOTCH3遺伝子変異は、R141CやC185R以外にも多くの種類が報告されています。今後、他の変異型のタンパク蓄積に対してもRFNGが関与するのかを調べる必要があります。また、動物モデルなどを用いて、RFNGが脳梗塞や認知症といった病態形成を促すのか検討する必要があります。CADASILの根本的な治療法は未だ確立されておりませんが、本研究を発端として、NOTCH3の糖鎖修飾を介した病態の解明や有効な治療法の確立が進むことが期待されます。
■用語解説
注1)CADASIL: 指定難病「皮質下梗塞と白質脳症を伴う常染色体優性脳動脈症」の英語略称。脳の小さい血管が障害されることで脳卒中(脳梗塞と脳出血)を繰り返して、認知症を発症する。
注2)NOTCH3: 細胞膜に存在する受容体タンパク質Notchの一種。細胞外および細胞内領域によって構成される。血管ではペリサイトに多く発現して、細胞の増殖や生存を促す役割を果たす。
注3)Radical Fringe(RFNG): Notch受容体に結合した糖鎖を伸長するタンパク質で、細胞間のコミュニケーションを調節する。このプロセスは、細胞の成長や分化に重要とされている。
注4)糖鎖修飾: グルコースなどの糖が結合して鎖状になった糖鎖がタンパク質に付加されること。糖鎖修飾はタンパク質の安定化や細胞間認識、タンパク質輸送などに関与し、細胞の機能調節に重要で、異常があると病気の原因にもなる。
注5)ペリサイト: 脳の小さい血管の周囲に多く存在する細胞。血管の内側に存在する血管内皮細胞と相互作用して脳血管の収縮や透過性の維持を担う。
注6)Notchシグナル: Notch受容体の細胞外領域が、別の隣接した細胞に発現する特定のタンパク質と結合することで活性化する情報伝達経路。シグナル活性化の過程では、Notchの細胞内領域が切断され、細胞の分化や増殖を制御する一方で、Notchの細胞外領域は分解される。
注7)C185R、R141C変異: CADASILで見られるNOTCH3遺伝子上に起こる変異の1つ。C185RとR141Cはそれぞれ、NOTCH3アミノ酸配列の185番目のシステイン(C)をアルギニン(R)に、141番目のアルギニン(R)をシステイン(C)に変化させる。
■研究プロジェクトについて
本研究は以下の研究助成金を受けて実施されました。
・日本学術振興会 (JSPS): 基盤研究(B) (JP21H0261), 特別研究員奨励費 (JP22KJ0484)
・革新医療創生CHIBA卓越大学院プログラム: 特別研究費 (2020~2023年度)
■論文情報
論文タイトル:The N-acetylglucosaminyltransferase Radical Fringe contributes to defects in JAG1- dependent turnover and signaling of NOTCH3 CADASIL mutants
著者:Shodai Suzuki, Taiki Mashiko, Yohei Tsukamoto, Miyu Oya, Yuki Kotani, Saki Okawara, Takemi Matsumoto, Yuki Mizue, Hideyuki Takeuchi, Tetsuya Okajima, Motoyuki Itoh
雑誌名:The Journal of Biological Chemistry
DOI:10.1016/j.jbc.2024.107787








