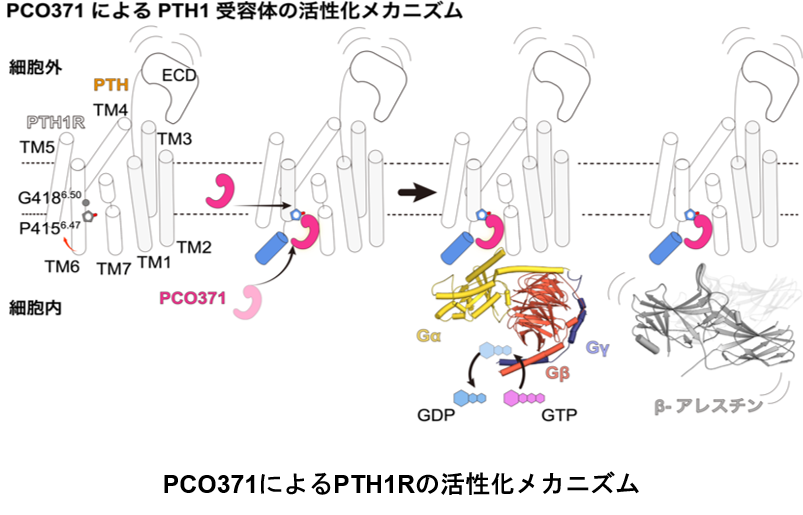
東京大学大学院理学系研究科の小林和弘博士課程学生(当時)、草木迫司助教、濡木理教授らの研究グループは、クライオ電子顕微鏡を用いた単粒子解析により、PCO371と結合したPTH1R及び三量体Gsタンパク質の立体構造を明らかにしました。Gタンパク質共役型受容体(GPCR)は生物の細胞膜に存在する7回膜貫通型の受容体タンパク質であり、最大の創薬標的となるタンパク質群です。一般にGPCRは、その細胞外領域にリガンドが結合することで、活性化型構造へと変化し、その構造変化を感知して細胞内に三量体Gタンパク質及びβアレスチンを結合させシグナルを伝達します。近年、特定のシグナル伝達のみを誘導できる”バイアス型作動薬”が開発され、薬剤の主作用と副作用を分離する方法論が期待されています。本研究の対象である副甲状腺ホルモン1型受容体(PTH1R)では、Gsタンパク質は薬効に関わる一方で、βアレスチンは副作用を生み出すことが知られており、Gsタンパク質選択的作動薬の開発が期待されています。本研究では低分子作動薬PCO371と結合したPTH1R及びGsタンパク質からなるシグナル伝達複合体の立体構造解析を行いました。その結果、PCO371がこれまでGPCRで報告されていない細胞内の薬剤ポケットに結合していることがわかりました。また、PCO371はPTH1Rに加えてGsタンパク質とも結合しており、2つのタンパク質をノリのように接合させる結合様式を持つことが明らかになりました。得られた構造に基づいて変異体機能解析を行ったところ、PCO371はGPCRに保存された細胞外の構造変化を起点とする共通の活性化メカニズムを介さず、細胞内に進入し、PTH1Rの細胞内ポケットを直接開口させるという新規の受容体活性化メカニズムを持つことを見出しました。これは、低分子薬物を用いてGPCRの細胞内領域を直接制御して、特定の下流のシグナルタンパク質を活性化するという手法論が可能であることを示します。また、PTH1Rのシグナル解析から、PCO371は三量体Gタンパク質のみを選択的に活性化する一方で、βアレスチンは全く活性化しないことを見出しました。PTH1Rがβアレスチンを介して副作用を生み出すことを踏まえると、このPCO371の薬剤プロファイルはPTH1Rを介した薬剤開発に適したものであり、細胞内領域に着目して薬剤を開発することにより、直接的バイアス型作動薬を開発することが可能であることが示唆されました。
この研究成果により、細胞内の新規薬剤ポケット領域を狙った薬剤開発及びバイアス型作動薬機構の分子基盤が提供されたため、細胞内領域を狙った薬剤開発及び副作用を軽減した薬剤開発への全く異なる創薬アプローチが可能になると期待されます。
プレスリリース本文はこちら









